Le vescicole sinaptiche granulari a core denso
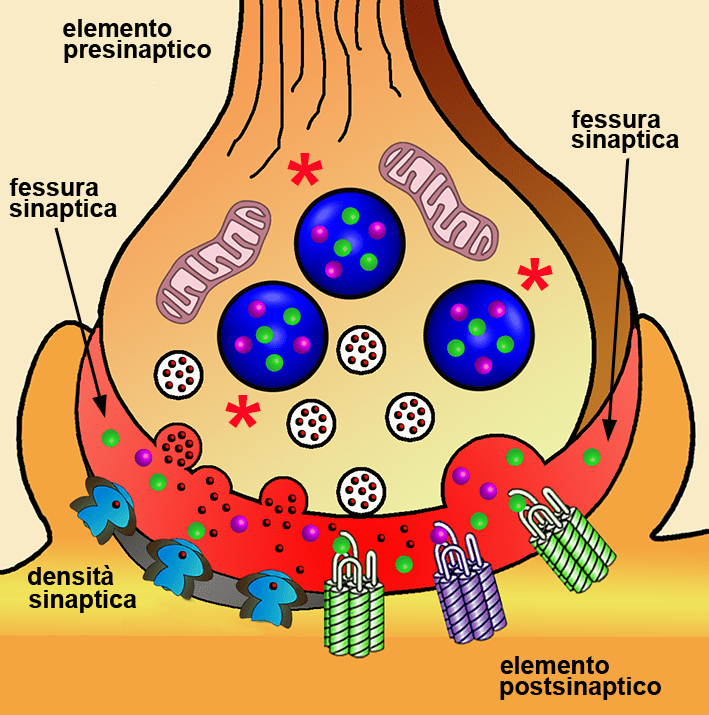
Le grandi vescicole granulari a core denso (LDCV) sono organelli di deposito per quelle proteine che vanno incontro a secrezione regolata come neuropeptidi e ormoni. Durante la loro formazione nella rete trans-Golgi, queste proteine secretorie vengono selettivamente accumulate nelle LDCV mediante aggregazione e il coinvolgimento di una varietà di segnali di smistamento. Le LDCV immature risultanti vengono trasportate lungo i microtubuli fino alla membrana cellulare, nella quale si muovono in modo F-actina-dipendente. Durante questa fase dinamica, le LDCV subiscono unna maturazione, che comprende l’acidificazione del lume, la sintesi e l’aggregazione delle proteine di trasporto e la rimozione delle proteine non specifiche delle LDCV mature. Infine, le LDCV vanno incontro a esocitosi per rilasciare il loro carico nella matrice extracellulare dopo stimoli appropriati.

Se vuoi saperne di più e capire meglio scorri la pagina verso il basso
I neuropeptidi
Le LDCV contengono in genere uno o più neuropeptidi. I neuropeptidi sono messaggeri chimici costituiti, in genere, da brevi catene di aminoacidi che vengono sintetizzati e rilasciati dai neuroni o dalle cellule neuroendocrine. I neuropeptidi in genere si legano ai recettori accoppiati a proteine G (GPCR – vedi figura in alto) per modulare l’attività dei neuroni. Molti neuropeptidi furono originariamente identificati come ormoni ipofisari o gastrointestinali
Probabilmente il primo neuropeptide ad essere identificato fu la vasopressina, un peptide di nove aminoacidi secreto dalle terminazioni nervose nel lobo neurale dell’ipofisi. La fonte della vasopressina sono i neuroni magnocellulari dell’ipotalamo, che inviano gli assoni alla neuroipofisi, che è il sito di rilascio nel sangue, secondo la classica modalità neurosecretoria. Come la vasopressina, anche numerosi peptidi gastrointestinali, come la colecistochinina (CCK), si trovano ad alte concentrazioni nel sistema nervoso. Nell’intestino, la CCK viene secreta dal duodeno e regola il rilascio degli enzimi digestivi e degli acidi biliari nell’intestino. A differenza della vasopressina e della CCK, i fattori di rilascio ipotalamici sono peptidi rilasciati in uno speciale sistema sanguigno portale che vascolarizza l’ipofisi anteriore, controllando la secrezione degli ormoni ipofisari. Il termine portale indica l’esistenza di due letti capillari successivi, uno nell’ipotalamo e uno nell’ipofisi anteriore. La sostanza P è un peptide di 11 aminoacidi scoperto all’inizio degli anni ’50 dello scorso secolo da estratti dell’intestino di cavallo polverizzati (da qui deriva il nome: P = powder). Appartiene alla famiglia delle tachichinine ed è stata inizialmente purificata come “peptide sialogogico”, provocando la salivazione in un test biologico. Ora la sostanza P è riconosciuta come un importante peptide bioattivo in molte vie neuronali, incluse quelle nocicettive.
I peptidi possono essere raggruppati per somiglianza strutturale e funzionale.
Come il GABA e il glutammato, che differiscono solo per un singolo gruppo carbossilico ma hanno funzioni molto diverse, molti neuropeptidi con strutture simili hanno funzioni molto diverse. La vasopressina e l’ossitocina sono i due principali peptidi neuroipofisari e ciascuno è costituito da nove aminoacidi. Questi due peptidi sono identici in sette di questi residui e si pensa che siano il risultato della duplicazione genetica nelle prime fasi dell’evoluzione. Le azioni dei due peptidi sono distinte: l’ossitocina provoca la produzione di latte e la contrazione uterina, mentre la vasopressina provoca ritenzione idrica nei reni e contrazione dei vasi sanguigni. Allo stesso modo, i peptidi degli oppiacei condividono una sequenza comune Tyr-Gly-Gly-Phe-Met/Leu al terminale NH2 e sono tutti potenti oppiacei endogeni ma con modelli distinti di selettività nelle varie classi di recettori degli oppiacei. I tre ormoni glicoproteici dell’ipofisi anteriore, l’ormone stimolante la tiroide (TSH), l’ormone luteinizzante (LH) e l’ormone follicolo-stimolante (FSH), condividono una subunità α comune ma hanno subunità β distinte e solo il dimero αβ è biologicamente attivo. Il gruppo delle tachichinine comprende la sostanza P e vari peptidi della pelle di rana, tutti con sequenze centrali simili e -Phe-X-Gly-Leu-Met-NH2 al terminale COOH. I peptidi gastrointestinali CCK e gastrina condividono una sequenza comune COOH-terminale (Trp-Met-Asp-Phe-NH2) e sono tra i pochi peptidi che subiscono solfatazione della tirosina. I siti d’azione della CCK e della gastrina sono distinti: la gastrina stimola la secrezione acida gastrica, mentre la CCK stimola il rilascio di enzimi e acidi biliari nell’intestino tenue. È interessante notare che il comune tetrapeptide COOH-terminale, sebbene inattivo nel tratto gastrointestinale, è abbondante nella corteccia cerebrale e svolge importanti azioni comportamentali.
La funzione dei peptidi come primi messaggeri è evolutivamente molto antica
In termini filogenetici, i neuropeptidi si sono affermati molto presto come molecole che intervengono nella comunicazione intercellulare. Nei celenterati, come l’Hydra, ci sono molti peptidi utilizzati nella neurotrasmissione, ma molti dei sistemi neurotrasmettitori “convenzionali”, come l’acetilcolina, le catecolamine e la serotonina, sono assenti. Nel gruppo animale più basso dotato di sistema nervoso, gli cnidari, di cui fanno parte gli anemoni di mare, i coralli, le meduse e l’idra, la rete nervosa è fortemente peptidergica.
Prova a rispondere a queste domande:
- Quale è la struttura chimica dei neuropeptidi?
- Su quale tipo di recettori agiscono i neuropeptidi?
- Qai sono le principali differenze fra neuropeptidi e neurotrasmettitori convenzonali?
- In quale compartimento cellulare sono immagazzinati i neuropeptidi e come vengono rilasciati dai neuroni?
- Cos’è la rete trans dell’apparato di Golgi?
(le risposte sono al fondo della pagina)


Ricordati di consultare un libro o cercare informazioni in rete se non conosci il significato di alcuni termini!
Risposte
1. I neuropeptidi sono piccole molecole proteiche costituite da una sequenza di aminoacidi in numero variabile da meno di una decina a poche centinaia
2. I neuropeptidi agiscono sui GPCR (recettori accoppiati alle proteine G). I GPCR sono proteine integrali di membrana contenenti un terminale amminico extracellulare, sette domini α-elicoidali transmembrana e un terminale carbossilico intracellulare. I GPCR riconoscono un’ampia varietà di segnali che vanno dai fotoni agli ioni, alle proteine, ai neurotrasmettitori e agli ormoni. Circa il 90% di tutti i GPCR appartengono alla famiglia della rodopsina.
3. Il neurotrasmettitori convenzionali hanno basso peso molecolare ed azione rapida; sono responsabili della maggior parte delle risposte immediate del sistema nervoso. I neuropeptidi hanno peso molecolare più elevato, azione più prolungata nel tempo e sono implicati in modificazioni a lungo termine del numero di recettori e la chiusura o l’apertura prolungata di alcuni canali ionici. I neurotrasmettitori a basso peso molecolare vengono sintetizzati nel citosol della terminazione presinaptica e, successivamente, mediante trasporto attivo sono immagazzinati all’interno delle vescicole presenti nel terminale sinaptico. Quando un segnale giunge al terminale sinaptico, poche vescicole alla volta liberano il loro neurotrasmettitore nella fessura sinaptica. Tale processo avviene in genere nell’arco di un millisecondo. I neuropeptidi, invece, sono sintetizzati come precursori nel soma neuronale.
4. I neuropeptidi sono sintetizzati a livello dei ribosomi del reticolo endoplasmatico ruvido (RER) Sono quindi trasportati all’interno del RER e da qui all’interno dell’apparato del Golgi, dove subiscono due principali modificazioni chimiche. Dapprima, la proteina da cui originerà il neuropeptide (pre-proneuropeptide) viene scissa enzimaticamente in frammenti più piccoli, alcuni dei quali costituiscono il neuropeptide biologicamente attivo o un suo precursore; successivamente, sempre nell’apparato di Golgi, il neuropeptide viene immagazzinato nelle LDCV che, poi, abbandonano il Golgi con un processo di gemmazione. Grazie al flusso assonale le LDCV sono trasportate alle estremità delle terminazioni nervose. In genere i neuropeptidi vengono liberati in quantità molto minori rispetto ai neurotrasmettitori a basso peso molecolare, ma ciò è compensato dal fatto che i loro effetti sono assai più potenti.
5. La rete trans dell’apparato di Golgi è un insieme di tubuli che costituisce l’ organulo cellulare responsabile dello smistamento delle proteine di secrezione verso le loro destinazioni finali.