Classificazione morfologica dei neuroni
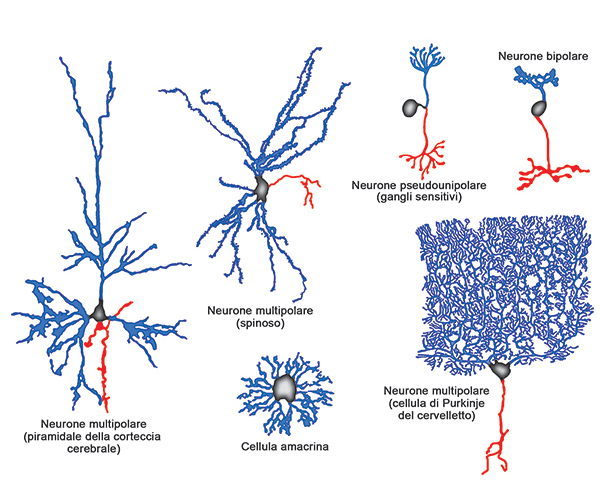
I neuroni possono essere classificati in modi diversi in relazione alla loro morfologia o alla loro funzione. Esistono almeno tre diverse classificazioni morfologiche. La prima si basa sul numero di prolungamenti per cui si possono distinguere:
- neuroni multipolari, con un assone e numerosi dendriti (es. motoneuroni del midollo spinale). Questa è la morfologia più comune.
- neuroni bipolari, con un assone e un dendrite che originano da poli opposti della cellula (es. neuroni dei gangli cocleare e vestibolare, cellule bipolari della retina).
- neuroni pseudounipolari (a T) con un unico prolungamento che si biforca dopo un breve tratto in due rami, uno centrale e uno periferico (es. neuroni dei gangli spinali).
- neuroni apparentemente privi di assone, i cui prolungamenti sono morfologicamente indistinguibili fra loro e presentano caratteri funzionali tipici sia dei dendriti sia degli assoni (es. cellule amacrine della retina).
Una seconda classificazione si basa sulle dimensioni del pericario e alla lunghezza dell’assone si possono riconoscere:
- neuroni del I tipo di Golgi, di grandi dimensioni con assone molto lungo (es. cellule di Purkinje del cervelletto).
- neuroni del II tipo di Golgi, con pericario di piccole dimensioni e assone breve (es. molti interneuroni della corteccia cerebrale e cerebellare).
Un terzo tipo di classificazione su base morfologica si basa sulla forma del neurone nel suo complesso, considerando sia il corpo cellulare che le ramificazioni assoniche e dendritiche. Questa classificazione è relativamente complessa perché sono stati identificati molti tipi diversi di neuroni nelle diverse parti del sistema nervoso centrale e periferico. I tipi più comuni sono:
- neuroni piramidali: sono neuroni tipici della corteccia cerebrale. Hanno il pericario a forma di piramide (triangolare in sezione); I dendriti alla base si distribuiscono in senso orizzontale, mentre il dendrite apicale si sviluppa in altezza. L’assone in genere si dirige verso le zone più interne della corteccia cerebrale, spesso entrando nella sostanza bianca sottocorticale. Sono cellule di dimensioni medio-grandi e in genere hanno un assone relativamente lungo o molto lungo (neuroni di proiezione).
- cellule stellate: hanno il corpo cellulare a forma di stella, i dendriti si ramificano nelle immediate vicinanze del soma e l’assone può contattare cellule adiacenti oppure distribuirsi ad altre zone limitrofe della sostanza grigia. Queste cellule hanno solitamente piccole dimensioni e funzionalmente sono interneuroni o neuroni a circuito locale.
- granuli: sono i neuroni con il pericario molto piccolo. In genere possiedono una ramificazione dendritica limitata nello spazio. L’assone più comportarsi in maniera diversa ma è sempre comunque relativamente breve. Come le cellule stellate anche i granuli funzionalmente sono interneuroni o neuroni a circuito locale.
- cellule fusiformi: hanno pericario a forma di di fuso con alle estremità due ciuffi dendritici. Si trovano frequentemente nella corteccia cerebrale. L’assone in genere abbandona la corteccia dirigendosi in profondità, ma in alcuni casi può raggiungere gli strati corticali più superficiali.
- altri tipi morfologici: prendono il loro nome, in genere, dal comportamento delle ramificazioni assoniche o dendritiche, dalla presenza di spine dendritiche o dalla posizione in una determinata area della sostanza grigia. Ne sono esempio le cellule dei canestri della corteccia cerebellare i cui assoni circondano il corpo cellulare dei neuroni di Purkinje, le cellule centrali della lamina II della sostanza grigia del midollo spinale, o le cellule a pennacchio del bulbo olfattivo i cui dendriti formano due evidenti ciuffi alle estremità del corpo cellulare.
n base alla funzione è invece possibile distinguere:
- neuroni motori, che inviano impulsi nervosi agli organi effettori (muscolatura striata e liscia, ghiandole)
- neuroni sensitivi, che sono sensibili a stimoli specifici di natura diversa (luminosa, chimica, termica, meccanica, ecc.) provenienti dall’ambiente esterno ed interno all’animale e li trasformano in impulsi nervosi (trasduzione del segnale nervoso). Queste cellule sono anche definite recettori1.
- interneuroni, i quali collegano funzionalmente fra loro gli altri tipi di neuroni formando circuiti più o meno complessi.
Un diverso tipo di classificazione funzionale si basa sulla distanza fra la sede del corpo cellulare e quella dei terminali assonici, vale a dire, in ultima analisi, sulla lunghezza dell’assone. Utilizzando questo criterio si distinguono:
- neuroni di proiezione, coinvolti nella comunicazione a lunga distanza. Morfologicamente queste cellule corrispondono a neuroni del I tipo di Golgi.
- neuroni a circuito locale, coinvolti nella comunicazione locale. Morfologicamente queste cellule corrispondono a neuroni del II tipo di Golgi.

Se vuoi saperne di più e capire meglio scorri la pagina verso il basso
L’attività antidromica nelle fibre sensitive e l’infiammazione neurogena
Il modo tradizionale di pensare al ruolo delle fibre sensitive afferenti è che, in seguito all’applicazione di qualsiasi stimolo nocicettivo, la sua energia sia trasdotta da un recettore (nocicettore) in un potenziale generatore locale a livello del terminale afferente primario. Se il potenziale generatore raggiunge la soglia, si producono potenziali d’azione che raggiungono ortodromicamente il midollo spinale. Tuttavia, una proprietà importante della conduzione nervosa è che la membrana eccitabile può generare potenziali d’azione in entrambe le direzioni a partire da un punto di depolarizzazione. Pertanto, quando le fibre nervose afferenti primarie vengono attivate in punti distanti dal recettore/terminale (a metà della lunghezza dell’assone o a livello dei gangli spinali), genereranno potenziali d’azione che vengono convogliati bidirezionalmente, ortodromicamente in direzione del midollo spinale e antidromicamente in direzione opposta. L’input ortodromico al midollo spinale depolarizza i terminali centrali portando a un rilascio extracellulare calcio-dipendente di neurotrasmettitori sui neuroni di secondo ordine . Il segnale antidromico viaggia perifericamente e provoca l’eccitazione dei terminali periferici dell’assone, determinando il rilascio calcio-dipendente dei neurotrasmettitori e dei fattori trofici presenti nei terminali stessi . È importante sottolineare che nei punti di ramificazione assonale, i potenziali d’azione possono essere convogliati lungo più di un collaterale assonale; quindi, il messaggio antidromico può essere trasmesso attraverso l’intero campo recettivo periferico dell’assone. I prodotti rilasciati hanno un impatto sostanziale sulla perfusione vascolare locale, sulla permeabilità capillare, sull’integrità/crescita dei tessuti e sulla funzione immunitaria, nonché sullo stato trofico dell’organo innervato.
La maggior parte dei neurotrasmettitori/neuromodulatori rilasciati dai neuroni sensitivi primari è sintetizzata e immagazzinata in vescicole a livello del corpo cellulare e quindi trasportata sia ai terminali centrali che a quelli periferici dell’assone afferente primario. Piccole molecole come il glutamato possono essere sintetizzate e accumulate nelle vescicole sinaptiche nel terminale. Molecole più grandi (peptidi) possono subire un processo traduzionale o post-traduzionale dopo essere state inglobate nelle vescicole anche se pare possano essere sintetizzate persino all’interno del terminale.
Il rilascio periferico dei trasmettitori afferenti svolge un ruolo fondamentale nell’infiammazione neurogena (vedi la figura sottostante). Gli effetti che ne derivano possono essere alquanto diversi.
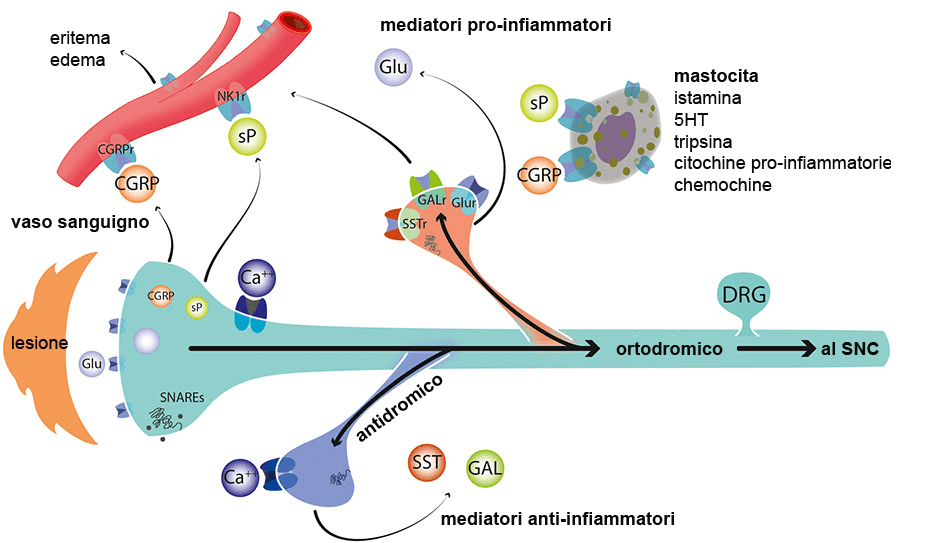
Effetti vasomotori periferici
Il rilascio periferico di mediatori pro-infiammatori provoca segni come arrossamento ed edema, i segni distintivi dell’infiammazione neurogena, che si sovrappongono virtualmente al campo recettivo sensoriale per ogni singolo assone . Il rilascio dei peptidi sostanza P e CGRP determina la dilatazione e l’aumento della permeabilità delle arteriole precapillari. La diffusione di molecole plasmatiche, come la bradichinina e la serotonina, fuori dal sistema vascolare può eccitare direttamente ulteriori nocicettori periferici. Gli effetti eccitatori acuti diretti del terminale periferico sulle cellule immunitarie sono scarsi; tuttavia, è stato dimostrato che l’attività afferente antidromica indotta elettricamente induce la degranulazione dei mastociti e ha effetti trofici sulla densità dei mastociti. L’entità dei cambiamenti risultanti nella perfusione locale e nell’eccitabilità terminale dipende non solo dalla specie esaminata ma anche dalle caratteristiche specifiche del tessuto innervato. L’infiammazione neurogena è presente non solo a livello della cute e delle articolazioni, ma si osserva anche in numerosi visceri appartenenti a diversi apparati.
Diametro e tipi di fibre afferenti
Non sorprende che l’infiammazione neurogena sia mediata da una combinazione di fibre finemente mielinizzate e non mielinizzate con diverse funzioni effettrici. Pertanto, la stimolazione elettrica delle fibre fini, ma non delle fibre di grosso diametro, provoca uno stravaso di plasma negli organi/tessuti periferici, ad es. la pelle e le articolazioni. L’attività antidromica esclusiva delle fibre Aδ produce vasodilatazione, mentre la stimolazione sufficiente ad attivare antidromicamente entrambe le fibre A e C sembra essere necessaria per indurre stravaso plasmatico ed edema. I fasci di fibre afferenti rilevanti possono includere anche piccoli assoni afferenti classificati come nocicettori “dormienti” o “silenti”. I prodotti rilasciati nell’ambiente locale da lesioni tissutali e infiammazione sensibilizzano prontamente questi recettori normalmente non responsivi. In queste condizioni, la soglia per l’attivazione scende a livelli molto bassi e, di conseguenza, la propensione dei nocicettori silenziosi ad avviare il rilascio di mediatori pro-infiammatori dai terminali contribuendo all’infiammazione neurogena verrebbe similmente abbassata.
Eterogeneità degli effetti periferici
Non tutte le fibre C hanno azioni vasodilatatrici periferiche. Nel ratto e nel coniglio questa azione sembra limitata a una sottopopolazione di nocicettori polimodali con soglie meccaniche relativamente elevate. Nel gatto pare queste fibre siano di tipo C e contengono sostanza P e CGRP. Nei suini, le fibre C interessate vengono attivate selettivamente dal calore. Nell’uomo, l’infiammazione dovuta al riflesso assonale sembra essere mediata dalle fibre C che sono insensibili alla stimolazione meccanica, piuttosto che dai comuni nocicettori polimodali.
Azioni pro versus antinfiammatorie
Infine, in un importante sottoinsieme di condizioni, tra cui le infezioni batteriche o l’artrite indotta da immunocomplessi, i terminali periferici dei nocicettori possono anche rilasciare neuropeptidi antinfiammatori, come la somatostatina e la galanina. Questi agenti possono modulare i linfonodi periferici e possono ridurre direttamente la quantità di citochine pro-infiammatorie rilasciate dai macrofagi infiltranti. Questi peptidi inibiscono anche il rilascio periferico di neuropeptidi pro-infiammatori dai terminali delle fibre C e quindi possono inibire lo stravaso plasmatico e l’edema. Il cambiamento dell’equilibrio degli effetti antidromici eccitatori e inibitori complica l’interpretazione dei risultati sperimentali e delle osservazioni cliniche.
Prova a rispondere a queste domande:
- Cosa si intende per fibre A e C?
- Qual è il neurotrasmettitore principale utilizzato dai neuroni dei gangli spinali?
- Cos’è un nocicettore silente?
- Cosa si intende per conduzione antidromica dello stimolo nervoso?
- Cosa sono le fibre afferenti (sensitive) primarie?
(le risposte sono al fondo della pagina)


Ricordati di consultare un libro o cercare informazioni in rete se non conosci il significato di alcuni termini!
Risposte
1. Le fibre nervose sensitive di tipo A sono mielinizzate, mentre quelle di tipo C sono amieliniche. Le fibre di tipo A hanno un diametro più grande e un’elevata velocità di conduzione dello stimolo nervoso. Le fibre C sono piccole e a conduzione lenta. Le fibre di tipo A sono a loro volta suddivise in fibre di tipo Aα, Aβ e Aδ in ordine decrescente di diametro e velocità di conduzione. Le fibre di tipo Aα sono presenti nei muscoli scheletrici e nei tendini; le fibre di tipo Aβ si trovano nella cute (meccanocettori), nel glomo carotideo, nel seno carotideo e nell’arco aortico (barocettori e chemocettori). Le fibre di tipo Aδ (scarsamente mielinizzate) si trovano nella cute (nocicettori e termocettori) come pure quelle di tipo C (nocicettori).
2. I neuroni dei gangli spinali utilizzano come neurotrasmettitore principale ad azione rapida il glutamato. Essi rilasciano anche trasmettitori di natura peptidica quali il CGRP e la sostanza P ad azione più lenta.
3. Un nocicettore silente è un neurone sensitivo specializzato nella raccolta di stimoli dolorifici prevalentemente a livello viscerale. Questi recettori sono sensibili alla torsione, alla distensione ed ai mediatori chimici prodotti dall’ischemia dei tessuti; presentano generalmente campi recettoriali ampi e sovrapposti, agendo in maniera coordinata nella recezione del segnale dolorifico, potendo sovrapporre dolore urente, pungente e localizzato, seguito da un dolore più diffuso e persistente.
4. La conduzione antidromica si riferisce a impulsi nervosi che dall’assone si propagano verso il corpo cellulare del neurone, esaurendosi nel corpo cellulare stesso.
5. Le fibre afferenti primarie sono i prolungamenti dei neuroni sensoriali del sistema nervoso periferico che trasducono stimoli meccanici, termici e chimici e li trasmettono al sistema nervoso centrale. Le afferenze primarie sono altamente specializzate in modo tale che popolazioni separate trasmettono informazioni su diversi tipi di stimoli (meccanici innocui, termici innocui e dolorifici.
- Il termine recettore può essere utilizzato per indicare la cellula in toto ma anche il solo prolungamento periferico a livello tissutale. ↩︎